آشنایی با ساختار شیمیایی اسید نیتریک
اسید نیتریک یا Nitric Acid با فرمول مولکولی HNO₃ یکی از اکسیدکنندههای قوی و از ترکیبات کلیدی در صنایع شیمیایی جهان بهشمار میآید. این ترکیب معدنی با رنگ بیرنگ تا زرد کمرنگ و بوی بسیار تند، به دلیل نقش بنیادی خود در ساخت کودهای نیتروژنی، نیتراتها، نیترات آمونیوم، مواد منفجره، رنگدانهها و داروسازی در راس مواد شیمیایی پرکاربرد قرار دارد. شناخت فرمول و ساختار مولکولی اسید نیتریک برای درک رفتار شیمیایی و ایمنی کار با آن ضروری است، زیرا ساختار الکترونی ویژه آن عامل اصلی قدرت اکسیدکنندگی و واکنشپذیری شدیدش است.
فرمول شیمیایی و ترکیب عناصر تشکیلدهنده نیتریک اسید
فرمول مولکولی اسید نیتریک ساده به صورت HNO₃ نوشته میشود ولی در واقع از دید مولکولی، این ترکیب شامل یک اتم هیدروژن (H)، یک اتم نیتروژن (N) و سه اتم اکسیژن (O) است. یون اصلی در درون این مولکول یعنی یون نیترات (NO₃⁻) مسئول رفتار اسیدی و واکنشهای اکسیدکنندهٔ آن است. در محلولهای آبی، اسید نیتریک تقریبا بهطور کامل یونیزه میشود و یونهای +H و NO₃⁻ را آزاد میکند و بنابراین در زمره اسیدهای قوی قرار میگیرد.
در حالت خالص، جرم مولکولی HNO₃ برابر با ۶۳ گرم بر مول و چگالی آن حدود ۱٫۵۱ گرم بر سانتیمتر مکعب در دمای ۲۵ درجه سانتیگراد است. این اعداد اگرچه ساده به نظر میرسند، اما در طراحی واحدهای صنعتی تولید نیتریک اسید و کنترل غلظت محلول اهمیت حیاتی دارند.
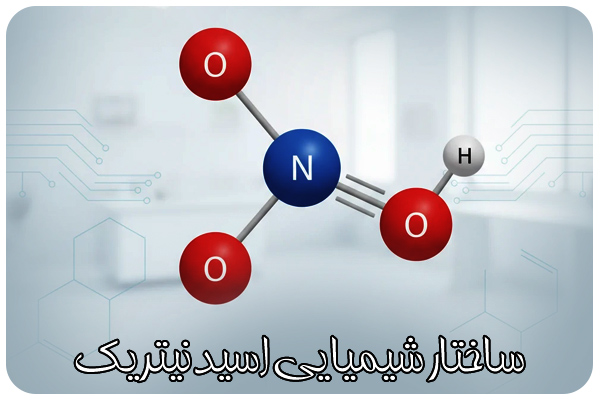
مدل لوییس و نحوه پیونددهی در مولکول اسید نیتریک
برای درک ساختار مولکولی ابتدا باید مدل لوییس (Lewis Structure) را بررسی کرد. اتم نیتروژن در هسته مرکزی قرار دارد و با سه اتم اکسیژن اطرافش پیوند دارد. یکی از این اکسیژنها از طریق پیوند دوگانه (N=O) متصل است، یک اکسیژن دیگر از طریق پیوند تکی (N–O) که به هیدروژن متصل میشود، و اکسیژن سوم نیز با پیوند تکی (N–O)** به ساختار متصل و دارای بار منفی رزنانسشونده است.
این چیدمان باعث میشود بار الکترونی در سه اتم اکسیژن در حالت رزونانس (Resonance) پخش شود و هیچ کدام از اکسیژنها بار دائمی مشخصی نداشته باشند. در واقع، ساختار واقعی اسید نیتریک ترکیبی از دو یا سه ساختار رزونانسی است که تفاوت در موقعیت الکترونهای π را نشان میدهد. این پدیده ثبات انرژی مولکول را افزایش میدهد و از دید شیمی کوانتومی عامل پایداری نسبی HNO₃ است.
شکل هندسی و زاویه پیوندها اسید نیتریک
تحلیل هندسی با استفاده از نظریه VSEPR (دفع زوجهای الکترونی والانس) نشان میدهد که مولکول HNO₃ تقریبا صفحهای (پلنار) است و اتم نیتروژن در مرکز مثلثی قرار دارد. زاویه بین پیوندهای N–O حدود ۱۲۰ درجه و زاویه بین O–N–O در واقع حدود ۱۳۰ درجه است. این آرایش سبب میشود چگالی بار در اطراف نیتروژن متقارن نباشد و مولکول خاصیت قطبی (Polar) قوی پیدا کند. همین قطبیت، انحلال خیلی زیاد اسید نیتریک در آب را توجیه میکند.
🎯 پیشنهاد مطالعه: خرید اسید نیتریک 55 درصد
پیوندها و توزیع بار الکترون نیتریک اسید
در مولکول HNO₃ سه نوع پیوند وجود دارد:
- پیوند N=O با ماهیت دو الکترونی π قوی، کوتاه و مستحکم
- پیوند N–O(H) که در اثر جدا شدن پروتون، پایه اسید را تشکیل میدهد
- پیوند N–O⁻ که در ساختار رزونانسی بار منفی در آن جابهجا میشود.
- تجزیهٔ بار الکترونی نشان میدهد نیتروژن دارای بار نسبی مثبت (+δ) و اکسیژنها دارای بار منفی (−δ) هستند. در نتیجه این توزیع بار، مولکول تمایل شدیدی به واکنش با ترکیباتی دارد که بتوانند الکترون دهی یا الکترون گیری انجام دهند. از این رو HNO₃ اکسیدکنندهای عالی محسوب میشود.
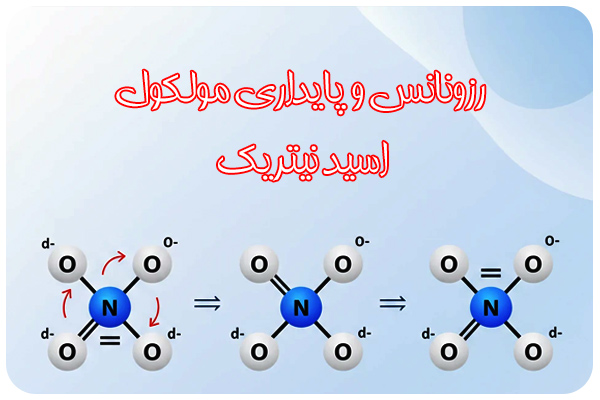
رزونانس و پایداری مولکول اسید نیتریک
مولکول اسید نیتریک نمونهای کلاسیک از رزونانس در آنیون نیترات (NO₃⁻) است. در هر لحظه، بار منفی در میان سه اکسیژن پخش شده و هیچ پیوند N–O مشخصا تکی یا دوتایی نیست. این پدیده پتانسیل انرژی را پایین میآورد و مولکول را پایدارتر از حالت بدون رزونانس میکند. وجود چنین ساختار رزونانسی باعث میشود نیتراتها در نمکهای فلزی بسیار پایدار باشند.
رفتار شیمیایی اسید نیتریک
رفتار شیمیایی HNO₃ حاصل همان آرایش الکترونی و پیوندهای آن است. چند نمونه از واکنشهای ویژهٔ آن عبارتاند از:
1- اسید نیتریک با فلزاتی مثل روی (Zn)، مس (Cu) و نقره (Ag) واکنش میدهد. بسته به غلظت محلول، محصولات متفاوت است:
2- با اسید رقیق، گاز نیتریک اکسید (NO) تولید میشود.مثال: Cu + 4HNO₃ → Cu(NO₃)₂ + 2H₂O + 2NO
با اسید غلیظ، گاز نیتروژن دیاکسید (NO₂) قهوهایرنگ آزاد میشود.Cu + 4HNO₃ (conc.) → Cu(NO₃)₂ + 2NO₂ + 2H₂O
این واکنشها پایهٔ تمایز رفتار اکسیدکنندگی در دو غلظت متفاوت هستند.
-
واکنش با بازها و اکسیدهای فلزی
HNO₃ با بازهایی مانند NaOH یا Ca(OH)₂ واکنش داده و نمک های نیترات را بهوجود میآورد.
HNO₃ + NaOH → NaNO₃ + H₂O
در این نوع واکنش، ماهیت اسیدی مولکول دیده میشود نه اکسیدکنندگی آن.
-
واکنش با مواد آلی و ترکيبهای گوگردی
در تماس با ترکیباتی مانند تولوئن، فنل یا سولفیدها، اسید نیتریک واکنشهای شدید و گرمازا اجرا میکند که میتواند منجر به نیتراسیون (Nitration) شود، مثلا تولید نیتروبنزن یا ترینیترو تولوئن (TNT). این همان ویژگی است که کاربرد نظامی و صنعتی اسید نیتریک را تعیین میکند.
هنگامی که اسید نیتریک غلیظ در معرض نور یا حرارت زیاد قرار گیرد، به صورت تدریجی تجزیه و بخارات NO₂ آزاد میکند:
4 HNO₃ → 2 H₂O + 4 NO₂ + O₂
همین پدیده دلیل تغییر رنگ اسید نیتریک به زرد قهوهای در بطری است.
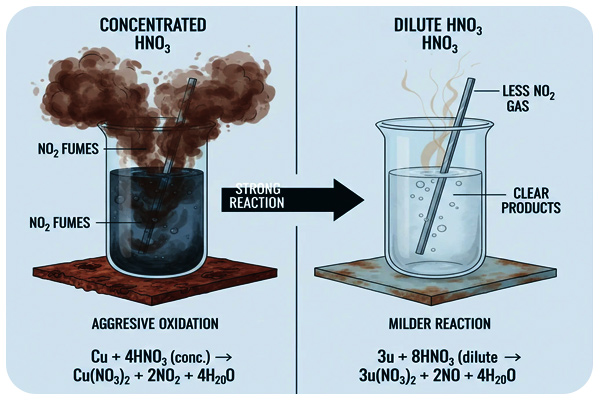
رفتار اسید نیتریک غلیظ و رقیق نیتریک
بیشتر خاصیت اسیدی ذاتی بروز میدهد و با فلزات فعالی مثل روی و آلومینیوم بهآرامی واکنش میدهد.
اکسیدکنندهای قوی است که حتی با ترکیبات غیر فلزی مانند یُد، گوگرد یا فسفر واکنش میدهد. بخارات NO₂ در این حالت آزاد میشود. همچنین اسید نیتریک غلیظ
خواص فیزیکی و رنگ مایع اسید نیتریک
درحالت خالص HNO₃ مایعی بیرنگ است اما در اثر تجزیه جزئی و تشکیل NO₂، رنگ آن به زرد تا قهوهای تغییر میکند.
- نقطه جوش: 83 درجه سانتی گراد
- نقطه انجماد: منفی 42 درجه سانتی گراد
- چگالی : تقریبا ۱٫۵۱ g/cm³
- به دلیل قطبیت قوی به راحتی با آب و اتانول امتزاج پذیر است اما این واکنش گرمازاست و باید به تدریج انجام شود.
توضیح رنگ و بو نیتریک
- بوی تند و زنندهٔ اسید نیتریک به دلیل ترکیب بخارات NO₂ و بخار خود HNO₃ است. گاز NO₂ قهوهای رنگ در تماس با رطوبت به سرعت به اسید نیتریک و اسید نیترو باز تبدیل میشود و این واکنش یکی از مسیرهای تشکیل باران اسیدی در اتمسفر است.
نقش ساختار در واکنشپذیری اسید نیتریک
ساختار خاص HNO₃ باعث میشود مولکول از دید الکترونی یک اکسیدکننده قدرتمند باشد. نیتروژن با عدد اکسایش +۵ در حالتی بسیار ناپایدار از نظر کوانتومی قرار دارد. و تمایل زیادی به کاهش به NO (+2) یا NO₂ (+4) دارد.
همین تغییر عدد اکسایش، محور اصلی اکسیدکنندگی در تمام واکنشهاست. بنابراین در واکنش با فلز یا ترکیب آلی، نیتریک اسید با پذیرش الکترون به نیتروژن اکسیدها تبدیل میشود.
کاربردهای مرتبط با ساختار مولکولی اسید نیتریک
1- در تولید کودهای شیمیایی، یون NO₃⁻ مستقیما به گیاه قابل جذب است.
2- در شیمی تجزیه و تحلیل کیفی، برای حل کردن نمونههای فلزی و تجزیهٔ اکسیدها به کار میرود.
3- نگهداری در بطری های شیشهای تیره، دور از نور و در دمای پایین از اهمیت زیادی برخوردار است.
اثرات ترمودینامیکی و انرژی اکسایش نیتریک
نیتروژن با عدد اکسایش +۵ در حالت اکسیده شدید قرار دارد. هنگامی که در یک واکنش، از +۵ به +۴ یا +۲ کاهش مییابد، انرژی زیادی آزاد میشود. همین آزادسازی انرژی علت اصلی گرمازایی شدید در واکنشها با فلزات و مواد آلی است.
-
اسید نیتریک در حالت آبپوشیده (Azeotrope)
محلول آزئوتروپ اسید نیتریک تقریبا دارای ۷۰٪ HNO₃ و ۳۰٪ آب است و در دمای ۱۲۱ سانتی گراد میجوشد.
-
واکنشپذیری الکتروشیمیایی
پتانسیل کاهش استاندارد برای یون NO₃⁻ در محیط اسیدی:
NO₃⁻ + 4H⁺ + 3e⁻ → NO + 2H₂O E° = +0.96 V
این عدد نشان میدهد که یون نیترات تمایل زیادی به پذیرش الکترون دارد و میتواند اکسیدکنندهای قوی باشد. به همین دلیل در الکتروشیمی و تحلیل فلزات کاربرد دارد.