خرید اسید نیتریک 55 درصد
برای خرید اسید نیتریک 55 درصد با کیفیت پایدار و عملکرد مطمئن، انتخاب تامینکنندهای معتبر اهمیت زیادی دارد. سبحان شیمی گیلان با عرضه اسید نیتریک ۵۵ درصد شفاف و یکنواخت، مناسب مصارف صنعتی و آزمایشگاهی، تلاش کرده فرآیند تامین مواد شیمیایی را برای مشتریان ساده و قابل اعتماد کند. این محصول با رعایت استانداردهای ایمنی، در بستهبندی مناسب ارائه میشود و امکان ارسال منظم آن برای مصرفکنندگان فراهم است. پاسخگویی تخصصی پیش از خرید نیز به شما کمک میکند تا با اطمینان کامل، اسید نیتریک موردنیاز خود را متناسب با کاربردتان تهیه کنید.
خرید اسید نیتریک از سبحان شیمی گیلان
در سبحان شیمی خرید اسید نیتریک از طریق سایت و همچنین با برقراری تماس با کارشناسام فروش انجام می شود. نیتریک 55 درصد صنعتی بصورت خرد و عمده به سراسر کشور عرضه می شود.

بسته بندی اسید نیتریک 55 درصد
یکی از مهم ترین نکاتی که برای صنایع در خرید اسید نیتریک 55 درصد صنعتی اهمیت دارد، تنوع بسته بندی محصول است. چرا که میزان مصرف با توجه به گنجایش و گستردگی صنایع بستگی دارد و تنوع بالای بسته بندی نیتریک صنعتی در سبحان شیمی انتخاب را برای مشتریان بسیار راحت می کند. برخی از بسته بندی ها در مجموعه ما:
-
گالن 5 لیتری
-
گالن 20 لیتری
-
بشکه 220 لیتری
-
تانکر 1000 لیتری
نحوه ارسال نیتریک اسید چگونه است؟
شما خریدار اسید نیتریک در هر شهری از کشور عزیزمان ایران که فعالیت دارید و مشغول تولید و تجارت هستید، می توانید بدون دغدغه و مشغولیت فکری درباره اینکه چگونه سفارش نیتریک بدستتان می رسد، خرید خود را از هر راه ارتباطی که راحت تر هستید، ثبت کنید. بعد از این دیگر همه چیز زیر نظر همکاران سبحان شیمی در بخش حمل و نقل به بهترین نحو برنامه ریزی می شود و در سریع ترین زمان ممکن سفارش شما بدستتان خواهد رسید.
📚 مطالعه کنید: شرح کامل ساختار شیمیایی اسید نیتریک
سبحان شیمی تولید کننده اسید نیتریک 55 درصد است؟
تولید اسید نیتریک 55 درصد توسط چند پتروشیمی معروف و با سابقه در حجم وسیع صورت می گیرد و بعد از طریق ثبت سفارش خرید نیتریک توسط شرکت های فروش مواد شیمیایی، توسط پتروشیمی بصورت تناژ بارگیری و در کارخانه بازرگانی های مواد شیمیایی در سراسر کشور تخلیه می شود.
شما به عنوان مصرف کننده و خرید کننده اسید نیتریک 55 درصد باید از طریف شرکت های بازرگانی مواد شیمیایی اقدام به خرید کنید، چرا که خرید این محصول از پتروشیمی ها نیازمند مجوزات متعددی است که در اختیار همه صنایع نیست.
اسید نیتریک 55 درصد چیست؟
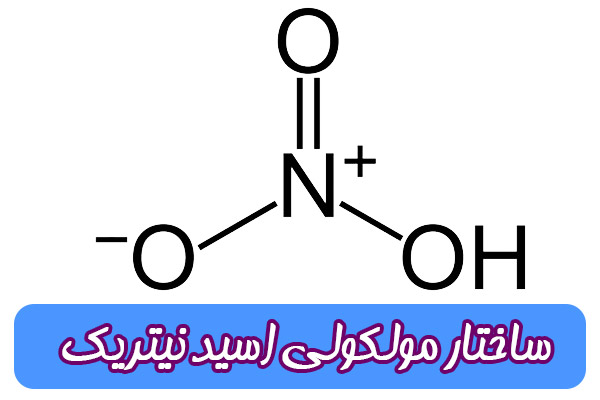
اسید نیتریک با فرمول شیمیایی HNO3 یک اسید معدنی با خاصیت خورندگی بالا است. شکل ظاهری آن بصورت مایع بی رنگ با بخارهای زرد و بوی تند. اما به دلیل تجزیه این اسید پس از مدتی به رنگ زرد بدل می شود. این ترکیب بسیار خورنده و سمی است و باعث سوختگی شدید پوست می شود. به عنوان یک عامل اکسید کننده قوی، معرف رایج در آزمایشگاه ها، تولید مواد منفجره و کودها کاربرد دارد.
این ماده اسیدی قوی است، زیرا هر چه اسید در محلول آبی بیشتر تفکیک شود آن اسید در گروه ترکیبات قوی قرار می گیرد. این ماده با شکستن یون هیدروژن و یون نیترات در آب کاملا تجزیه می شود. اسید نیتریک در دمای پایین، درون آب کاملا حل خواهد شد. یکی از دلایل اصلی خرید اسید نیتریک، ساختن آمونیوم نیترات برای کودهای شیمیایی است.

مشخصات شیمیایی اسید نیتریک
فرآیند تولید اسید نیتریک 55 درصد چگونه است؟
امروزه اسید نیتریک از طریق فرایند استوالد، از اکسیداسیون آمونیاک در هوا و با حضور کاتایزور پلاتین در دمای 900 درجه سانتی گراد بدست می آید.
NH۳ (g) + ۵ O۲ (g) → ۴ NO (g) + ۶ H۲O (g)
اکسید نیتریک بدست آمده از واکنش قبلی مجددا اکسید شده و دی اکسید نیتروژن را تشکیل می دهد.
NO (g) + O۲ (g) → ۲ NO۲ (g)
در مرحله بعدی دی اکسید نیتروژن با آب ترکیب و منجر به تولید اسید نیتریک می شود.
NO۲ (g) + H۲O (l) → ۲ HNO۳ (aq) + NO (g)
یکی دیگر از روش های تولید اسید نیتریک استفاده از گاز اسید سولفوریک به جای هوا است. برای تولید اسید نیتریک با این روش نیاز به کوره هایی با دمای 150 تا 170 درجه سانتی گراد است. که برخلاف روش قبل گران تر بوده و به انرژی کمتری مورد نیاز است.
اسید نیتریک از طریق روش بریک لند نیز می توان تهیه کرد. در این روش از گاز اکسیژن و نیتروژن استفاده می شود. اما با توجه به کم بودن غلظت اکسید نیتروژن و میزان انرژی بالای الکتریکی مورد نیاز، هزینه بر بوده و امکان برگشت واکنش در دمای بالا وجود دارد.
تولید نیتریک صنعتی در زمان های قدیم چگونه بوده است؟
در قرن شانزدهم برای جداسازی طلا از نقره از نیتریک اسید استفاده می شد. اسید نیتریک از شوره به دست می آید، به گونه ای که سولفات آهن را در حالت گرم روی شوره اثر می دادند. این روش تولید نشان می داد که شوره مصرفی، خالص بوده است، مقداری ماسه، آهک یا سفال شکسته به ترکیب این دو ماده اضافه می کردند، ماده حاصل را در یک شیشه درب دار می ریختند و این شیشه ها را در کوره آهک پزی قرار می دادند.
سپس این شیشه ها را در خاک یا خاکستر قرار داده، که سبب پخش گرما و جلوگیری از ترک برداشتن شیشه می شد. از درپوش شیشه ها لوله هایی خارج می شد که به همین تعداد شیشه های مایع کننده، روی سکویی خارج از کوره متصل بودند. این اتصالات به دقت آب بندی می شدند. حرارت در ابتدا کمی معتدل بود تا ماده خام درون شیشه ها خشک شود، بعد حرارت را زیاد می کردند، گازهای نیترو به وسیله آب تبلور نمک ها، به خارج کشیده می شد. زمانی که رنگ محصول تقطیر نشان می داد که تجزیه به پایان رسیده است، حرارت را کاهش می دادند تا ماده مورد نظر حاصل شود.
نگهداری اسید نیتریک در گالن پلاستیکی مخصوص
اسید نیتریک به دلیل اینکه به سرعت در معرض هوا دچار واکنش های شیمیایی شده و با سرع بسیا بالایی تجزیه می شود، بادی در گالن های پلاستیکی مخصوص اسید برای طولانی مدت نگهداری شود. این واکنش ممکن است باعث ایجاد برخی تغییرات غیر قابل اغماض در فشار بخار بالای مایع شود، زیرا اکسیدهای نیتروژن تولید شده تقریبا در اسید حل می شوند.
هنگامی که دی اکسید نیتروژن (NO۲) در اسید نیتریک حل می شود، رنگ آن در دمای بالاتر به زرد یا حتی قرمز تغییر می کند. اسید با دی اکسید نیتروژن محلول بخارهای قهوه ای مایل به قرمز را نشان می دهد و منجر به تشکیل ترکیبی به نام نیتریک اسید بخور قرمز و نیتریک اسید بخور سفید می گردد. اکسیدهای نیتروژن (NOX) در اسید نیتریک محلول هستند.
موارد مصرف و کاربرد اسید نیتریک 55 درصد در صنایع
| فلزات |
در بازیافت پلاتین از اسید نیتریک استفاده می شود و باتوجه به این که تمامی نیترات های فلزات محلول هستند از این طریق می توان، اورانیوم خالص را تهیه کرد که در نیروگاه های اتمی مصرف می شود. در استخراج طلا و در بازیافت ضایعات الکترونیک نیز از اسید نیتریک استفاده می شود.
|
| کشاورزی |
بیشترین مصرف نیتریک اسید در تهیه کودهای شیمیایی (کشاورزی) از قبیل کودهای نیترات (نیترات کلسیم، نیترات آمونیوم و غیره) است. ساخت کودهای شیمیایی نیتروژن دار مانند: اوره، آمونیوم نیترات، نیتروفسفات، کودهای مخلوط و غیره می باشد.
|
| مواد منفجره و مهمات |
به دلیل قدرت اکسید کنندگی زیاد، نیتریک اسید در حین تماس با ترکیباتی مانند سیانیدها و کاربیدها سبب انفجار می شود. از دیگر مصارف نیتریک اسید تولید موادی مانند سایکلو تری متیلن تری نیترامین، ماده منفجره مانند نیتروگلیسیرین و تری نیتروتولوئن می باشد. در تولید نیترات های معدنی (نیترات آمونیوم انفجاری) و آلی از نیتریک اسید به وفور استفاده می شود.
|
| سوخت مایع شاتل ها |
از دیگر مصارف اسید نیتریک ۱۰۰ درصد استفاده از آن به عنوان اکسید کننده در سوخت مایع شاتل های فضایی موشک، سوخت مایع در رشته مهندسی هوافضا و همچنین در راکت ها است و از اسید نیتریک بالای ۸۵ درصد (اسید نیتریک قرمز) به همراه اسید سولفوریک به عنوان اکسید کننده استفاده می شود.
|
| تهیه تیزاب |
در تهیه تیزاب و یا نیترو هیدروکلریک اسید (ترکیب اسید نیتریک غلیظ با اسید کلریدریک غلیظ با نسبت ۱ به ۳) از اسید نیتریک استفاده می شود. این ماده خاصیت دود کننده و خورنده زرد یا قرمز دارد. همچنین قدرت بالای این دو اسید ترکیبی، موجب شده است تا از آن در موارد مختلفی از جمله حل کردن فلزات نجیب، اسید شویی فلزات و تشخیص عیار طلا از فلز مشکوک به آن بهره برد. لازم به ذکر است که اسید تیزاب بسیار خطرناک و خورنده می باشد، پس هنگام کار با نیتریک اسید ترکیب اسیدی قوی نکات ایمنی را رعایت کنید.
|
| تصفیه لوله ها |
برای تولید گروه های عاملی روی سطح نانو لوله های کربنی، آن ها را در محیط آبی به صورت کاملا هموژن دیسپرس می کنند. به همین خاطر ابتدا نانو لوله های کربنی در محیط های اسیدی مختلف از قبیل اسید نیتریک، اسید سولفوریک و اسید کلریدریک دیسپرس می شوند.
|
| تمیزکاری و اسید شویی |
همچنین (۵ تا ۳۰) درصد اسید نیتریک به همراه (۳۰ تا ۴۰) درصد اسید فسفریک برای تمیز کردن رسوبات، ترکیبات کلسیمی و منیزیمی روی ظروف خوراکی و لبنیات استفاده می شود. از دیگر ویژگی های اسید نیتریک خورندگی بالا و حلالیت بالا (فلزات را براحتی در خود حل می کند) می باشد و این اسید در شست و شو نیز کاربرد فراوانی دارد.
|
| صنایع غذایی |
برای جلوگیری از رشد باکتری ها و مسمومیت های غذایی کشنده در این فراورده ها از یون نیتریت (-NO۲) استفاده می شود. این ماده به عنوان افزودنی به گوشت تازه و برای ثابت ماندن رنگ گوشت قرمزمصرف می شود. به همین دلیل گوشت های قرمز تازه ای که خریداری می کنید لزوما کشتار روز نیستند و ممکن است مقداری نیتریت به آن افزوده باشند.
|
از دیگر کاربردهای نیتریک اسید می توان به موارد زیر اشاره می کرد:
-
آبکاری
-
تولید دارو
-
عکس برداری
-
تولید ترکیبات آلی خاص
-
استفاده به عنوان واکنشگر آزمایشگاهی
-
تهیه پلیمرهایی مانند: پلی آمید و پلی اورتان
-
بعنوان ماده اولیه جهت تولید آدیپیک اسید
-
مسن کردن مصنوعی چوب درختانی مثل کاج و افرا
-
در تست رنگ سنجی برای تشخیص هروئین و مورفین
-
صنایع پلاستیک سازی و پیش سازهای نایلونی و صنایع شیرسازی
-
به منظور تمیز کردن شیشه پیش از ساختن آینه های نقره اندود
-
قابل استفاده در تست تشخیصی آلکانوئید هایی همچون LSD
-
استفاده از نوع پایدار تر در صنایع رنگ سازی و جوهرها به عنوان رنگدانه
-
استفاده برای ساخت نمک های نیترات آمونیوم، نیترات نقره و نیترات کلسیم
-
مقاوم سازی در برابر خوردگی و از بین بردن مواد ته نشین شده در کارخانجات لبنی
-
متالوژی: در ترکیب با الکل برای حک کردن طرح روی فلزاتی مانند برنج، مس و برنز
-
جهت تمیز کردن سطوح شیشه ای مختلف از جمله لام های میکروسکوپ به صورت جدا یا همراه با اسید کلریدریک
کاربرد اسید نیتریک در اسید شویی فلزات
اسید نیرتیک خاصیت اکسید کننده ایی و اسیدی دارد و به عنوان ماده ایی شیمایی برای شستشو نیز استفاده می شود. از این ماده جهت شست و شوی قطعات فلزی به عنوان ماده ایی حل کننده و برای شستشوی لوله های پر کربنات در تولید غذا و نوشیدنی به کار می رود.
اسید نیتریک 55 درصد صنعتی در شستشوی فلزات به دلیل خاصیت اکسید کنندهاش، لایههایی از زنگزدگی، رسوب و اثرات دیگر را حذف میکند. همچنین باعث تمیز شدن سطح فلزی میشود و از خوردگی فلزات جلوگیری میکند. به عنوان نمونه، اسید نیتریک برای تمیز کردن و رفع زنگ زدگی ابزارهای کشاورزی و باغبانی مانند قطعات دستگاههای کاشت و برداشت کاربرد دارد.

کاربرد اسید نیتریک 55 درصد در صنعت مواد غذایی
اسید نیتریک در مواد غذایی به عنوان یک ماده نگهدارنده استفاده میشود. این ماده در صنعت غذایی برای جلوگیری از رشد باکتریهای خطرناک، به ویژه باکتری کلستریدیوم بوتولینوم، که میتواند سمی برای انسان باشد، به کار میرود.
همچنین، اسید نیتریک به عنوان یک ماده رنگدهی در برخی از محصولات غذایی مانند گوشت و ژامبونها نیز استفاده میشود. این ماده به محصولات غذایی رنگ قرمز تیره میبخشد و از لحاظ اقتصادی میتواند به عنوان یک جایگزین برای رنگدانههای طبیعی باشد.
همچنین استفاده از اسید نیتریک در برخی از محصولات غذایی مانند شیرینی و نان، میتواند در بهبود عملکرد خمیر، ترشح بخار و ماندگاری محصولات به کار رود.
با این حال، مصرف بیش از حد اسید نیتریک در مواد غذایی میتواند به سلامتی آسیب برساند. برای همین، استفاده از این ماده به صورت محدود و توسط کارشناسان متخصص توصیه میشود.
اسید نیتریک در برخی از مواد غذایی به صورت طبیعی وجود دارد، و در برخی موارد به عنوان ماده افزودنی به غذاها اضافه میشود. به عنوان مثال:
در گوشت قرمز و محصولات گوشتی نظیر سوسیس، کالباس، سالامی و … به عنوان یک ماده نگهدارنده و رنگ دهی به کار میرود.
در محصولات لبنی مانند پنیر و کره نیز به عنوان ماده نگهدارنده و در برخی موارد جهت تغییر رنگ به کار میرود.
در برخی از محصولات نان، شیرینی و کیک به عنوان یک عامل افزایش دهنده عملکرد خمیر به کار میرود.
مصرف بیش از حد اسید نیتریک در مواد غذایی به سلامتی آسیب میرساند. برای همین، استفاده از این ماده به صورت محدود و با رعایت دستورالعملهای بهداشتی توصیه میشود.
کدام فلزات در نیتریک اسید حل می شوند؟
اسید نیتریک یکی از قویترین اسیدهای شیمیایی است و قادر به حل بسیاری از فلزات مختلف است. در واقع، اسید نیتریک اغلب به عنوان یک (محلول آبی فریبنده) شناخته میشود زیرا بسیاری از فلزات را در خود حل میکند و باعث میشود فلزات شبیه به نقره، طلا، مس، روی، آلومینیوم و بسیاری دیگر، به رنگ شیشهای آبی در معرض آن از بین بروند.
اصلیترین واکنشی که اسید نیتریک در برخورد با فلزات نشان میدهد. واکنش اکسیداسیون است. در این واکنش، اسید نیتریک اکسیژن خود را به فلزات منتقل میکند و فلزات را به اکسید تبدیل میکند. این واکنش بسته به شدت و غلظت اسید نیتریک، ممکن است شدید و نفوذ کننده یا ملایم و کنترل شده باشد.
به عنوان مثال اسید نیتریک میتواند مس را به مس نیترات، روی را به روی نیترات و آلومینیوم را به اکسید آلومینیوم تبدیل کند. ولی در مقابل فلزاتی مانند آهن و نیکل که قدرت اکسیداسیون کمتری نسبت به دیگر فلزات دارند، اسید نیتریک معمولا تنها روی سطح فلزات ایجاد یک لایه اکسید رقیق میکند.

اسید نیتریک 55 درصد قوی است یا ضعیف؟
اسید نیتریک یکی از قوی ترین انواع اسید در شیمی است و از اسیدهای معدنی شدید مانند اسید هیدروکلریک و اسید سولفوریک نیز قوی تر است. این به این معنی است که در محلول آبی، اسید نیتریک به طور کامل یونی شده و یون های هیدروژن (H+) را به آب منتقل می کند. بنابراین محلول اسید نیتریک در آب دارای pH کمتر از 7 (به عنوان یک اسید) است. این خصوصیات آن باعث شده است که اسید نیتریک به عنوان یک اسید قوی شناخته شود و در عملهای شیمیایی و صنعتی به عنوان یک عامل اکسید کننده و اسیدی قوی مورد استفاده قرار گیرد.
اسید نیتریک بدون آب چیست؟
اسید نیتریک خالص یا WFNA بسیار نزدیک به اسید نیتریک بی آب است. با سنجش به عنوان اسید نیتریک 9/99 درصد در دسترس است. یکی از مشخصات اسید نیتریک بخور سفید این است که حداکثر 2 درصد آب و حداکثر 0.5 درصد NO2 محلول دارد.
جوهر شوره بی آب دارای تراکم 1.513 گرم در سانتی متر مکعب است و غلظت تقریبی آن 24 مولار است. اسید نیتریک بی آب یک مایع متحرک بی رنگ با تراکم 1.512 گرم در سانتی متر مکعب است که در دمای 42- درجه سانتیگراد جامد می شود و بلورهای سفید تشکیل می دهد.
با تجزیه شدن آن به NO2 و آب، رنگ زرد به دست می آورد. در دمای 83 درجه سانتی گراد می جوشد. این ماده معمولا در یک بطری شیشه ای کهربای ضد شکن و با دو برابر فضای سر نگهداری می شود تا امکان ایجاد فشار فراهم شود، اما حتی با این اقدامات احتیاطی بطری باید ماهانه تخلیه شود تا فشار خارج شود.
تاریخچه اسید نیتریک صنعتی
اسید نیتریک را از شوره به دست میآورند، بدین طریق که سولفات آهن یا زاج را در حالت گرم روی شوره اثر میدادند. این طریقه تولید نشان میدهد که شوره مصرفی خالص بوده است. به ترکیبی از دو ماده، کمی ماسه، آهک یا سفال شکسته میافزودند، ماده به دست آمده را در یک شیشه کوچک در دار میریختند. این شیشهها را در کوره آهک پزی میگذاشتند که میتوانست دو ردیف از این شیشهها را که هر ردیف چهار تا شیشه بود دربرگیرد. این شیشهها را تا گردن در خاک یا خاکستر که سبب پخش گرما و جلوگیری از ترک برداری شیشه میشد، قرار میدادند.
از در پوش شیشهها لولههایی خارج میشد که به همین تعداد شیشههای مایع کننده بر روی سکویی خارج از کوره متصل بودند. همه اتصالات بهدقت آببندی میشدند. حرارت نخست معتدل بود تا ماده خام درون شیشهها خشک شود، سپس هر شش ساعت به شش ساعت حرارت را زیاد میکردند، گازهای نیترو به وسیله آب تبلور نمکها به خارج کشیده میشد. هر وقت رنگ محصول تقطیر نشان میداد که تجزیه به پایان رسیدهاست، حرارت را به تدریج کم میکردند.
روش سولفات آهن باز به وسیله گلاوبِر شرح داده شدهاست. این روش بدون شک تا آغاز سده هجدهم، تنها روش مورد استفاده برای تولید نیتریک اسید بودهاست. انگلیسیها و هلندیها تا مدتها بعد هم از روش سولفات آهن استفاده میکردند، اما در فرانسه روش آلومین جای آن را گرفت.
در سده پیش، تولیدکنندگان اسید نیتریک گمان میبردند که بازده تولید با روش آلومین از بازده آن با سولفات آهن کمتر است. کمی پس از آن نظر مخالف غلبه یافت بدون اینکه معلوم شود که برپایه کدام مشاهدات این تغییر عقیده ایجاد شدهاست. بدیهی است که کار آزمایشگاهی در این عمل بی تأثیر بودهاست. محتوای کتابهای شیمی شامل دستورهای نسخه مانندی است که مؤلفان آنها از عمل کنندگان دریافت داشتهاند. گویا تغییرات در روشهای سنتی در نتیجه ایجاد بازار بهتر و تقاضاهای بیشتر بودهاست.

واکنش اسید نیتریک با طلا
طلا یکی از فلزات نجیب و با ارزش است که با اکثر اسیدها واکنش نمیدهد. در واقع، طلا در برابر بسیاری از اسیدها، شامل اسید نیتریک، غیر فعال است.
اما با اضافه کردن یک عامل اکسید کننده به اسید نیتریک، مانند کلرید آمونیوم، میتوان طلا را حل کرد. در واقع، واکنش اسید نیتریک با کلرید آمونیوم و طلا به شکل زیر است:
Au + 3HNO3 + 4NH4Cl → [AuCl4]^- + 3NO + 4NH4+ + 3H2O
در این واکنش اسید نیتریک صنعتی به عنوان یک عامل اکسید کننده عمل میکند و کلرید آمونیوم به عنوان یک عامل محافظ از اکسید شدن نیتروژن در اسید نیتریک عمل میکند. به دلیل کمیابی طلا، این واکنش معمولاً در مقیاس صنعتی استفاده نمیشود، با این حال، میتواند برای آزمایشات و پژوهشهای شیمیایی کاربردی باشد.
نکات ایمنی استفاده از اسید نیتریک
اسید نیتریک ترکیبی خطرناک قابل اشتعال و خورنده است و بهتر است پیش از کار با آن برگه اطلاعات ایمنی مربوط به آن را مطالعه کنید.
-
حتما در محیطی باز یا دارای تهویه با آن کار کنید.
-
در زمان کار از لباس، عینک و دستکش محافظ استفاده کنید.
-
پس از استنشاق محیط کار را ترک و هوای تازه استشمام کنید.
-
با رعایت نکات ایمنی خطرات ناشی از کار با این ماده را کاهش دهید.
-
این ترکیب را در ظرف در بسته در محیطی خشک و دارای تهویه نگهداری کنید.
-
در صورت بلع تصادفی دهان را با آب بشویید و سعی نکنید با استفراغ آن را خارج کنید.
-
پس از تماس با پوست، فورا لباس ها را تعویض کرده و آن ناحیه را برای 15 دقیقه با آب فراوان بشویید.
-
برای خاموش کردن آتش از کربن دی اکسید، مواد شیمیایی خشک یا کف های خاموش کننده استفاده کنید.
-
در صورت تماس با چشم برای 15دقیقه با آب فراوان چشم آسیب دیده را بشویید و لنز تماسی را خارج کنید و شستشو را ادامه دهید.
خطرات اسید نیتریک برای سلامتی انسان
اسید نیتریک یک اسید خورنده و یک ماده اکسیدکننده قوی است. عمده خطرات نیتریک اسید شامل سوختگیهای شیمیایی است، زیرا اسید با پروتئینها و چربیها روی پوست، واکنش هیدرولیز انجام میدهد، در نتیجه بافت زنده تجزیه میشود.
-
اثر کوتاه مدت با نیتریک اسید
اسید نیتریک برای پوست، چشم و دستگاه تنفسی مضر است. استنشاق آن می تواند باعث آسم و سبب تورم در گلو شود و بلعیدن آن آثار مخربی دارد. در اینصورت سریعا با اورژانس تماس بگیرید.
از آن جایی که تماس با پوست می تواند منجر به سوختگی های شدید شود، سریعا لباس های آلوده شده را در آورده و پوست را با مقادیر فراوان آب حداقل به مدت ۱۵ دقیقه شستشو دهید.
-
اثر بلند مدت با نیتریک اسید
استنشاق طولانی مدت موجب آسیب به دندان و پوسیدگی آن ها می شود. این ماده روی شش ها، ریه و دستگاه تنفسی آثار فراوانی دارد و همچنین باعث کاهش عملکرد ریه می شود. نیتریک اسید معدنی در غلظت های بالا سبب بروز سرطان می شود.
بصورت کلی هنگام کار با اسید های قوی همچون نیتریک اسید 55 درصد از تجهیزات ایمنی شامل عینک، دستکش لاتکس و روپوش استفاده کنید. همچنین هنگام کار با اسید نیتریک غلیظ به منظور به حداقل رساندن پخش بخارات سمی این اسید و تحریک سیستم تنفس، از هود آزمایشگاهی استفاده کنید.