خرید محلول شیمیایی ✔️ فروش انواع محلول قیمت عمده
خرید انواع محلول شیمیایی به قیمت عمده
سبحان شیمی گیلان به عنوان یکی از تامین کنندگان مواد شیمیایی با هدف تامین نیاز بازار و همچنین تکمیل کردن سبد خریداران، اقدام به فروش انواع محلول شیمیایی در سایت مجموعه کرده است. شما مصرف کنندگان و یا فروشندگان عزیز می توانید جهت ثبت سفارش خرید محلول شیمیایی از طریق سایت و یا تماس مستقیم با کارشناسان فروش اقدام نمایید.
محلول چیست؟
محلول مادهای است که در آن مادهای به نام حلشونده به طور یکنواخت در مادهای به نام حلال، حل و پراکنده شده است. در محلول نسبت حلال به حلشونده بیشتر است و فاز محلول را حلال تعیین میکند. ذرات حلشونده در محلول، بین مولکولهای حلال قرار میگیرند و حلال و حلشونده با یکدیگر واکنش نمیدهند. در شکل زیر تعریفی از مواد و محلول نمایش داده شده است.

محلول ها را کجا می توان دید؟
محلولها همه جا و در محیط زندگی ما حضور دارند. بیشتر موادی که میبینیم مخلوطی از یک حلشونده در ماده دیگر هستند. انواع گوناگونی از محلولها وجود دارند. محلولها میتوانند به حالت مایع، گاز یا جامد باشند. هوا که مخلوطی همگن از چند گاز است در دسته محلول گازی قرار میگیرد. نوشابههای گازدار مخلوطی همگن از گاز کربن دیاکسید در آب و قهوه یا چایی محلولی مایع از دانههای قهوه یا برگهای چای با آب داغ هستند. آب اقیانوسها و دریا محلولی از ترکیبات زیادی مانند نمک در آب است.
فرآیند انحلال پذیری چگونه است؟
بیشترین مقدار حل شونده که می تواند در یک مقدار معینی از یک حلال مخصوص در یک دمای خاص، حل شود را انحلال پذیری آن ماده در این حلال می گویند. وقتی یک محلول شیمیایی در یک حلال حل می شود ابتدا پیوند بین مولکول های حلال شکسته و اجزای آن از هم جدا می شود. همچنین پیوند بین مولکول های حل شونده نیز از هم گسسته و سپس بین مولکول های حلال و حل شونده پیوند جدید برقرار شده و حل شونده به اصطلاح در حلال حل می شود.
در این فرآیند شکستن پیوندها احتیاج به انرژی دارد و تشکیل پیوندها با آزاد شدن انرژی و گرما همراه است که به این گرما، گرمای انحلال می گویند. اگرمیزان انرژی آزاد شده بیشتر باشد فرآیند گرمازا و اگر میزان انرژی مصرف شده زیاد باشد فرآیند انحلال گرماگیر خواهد بود.
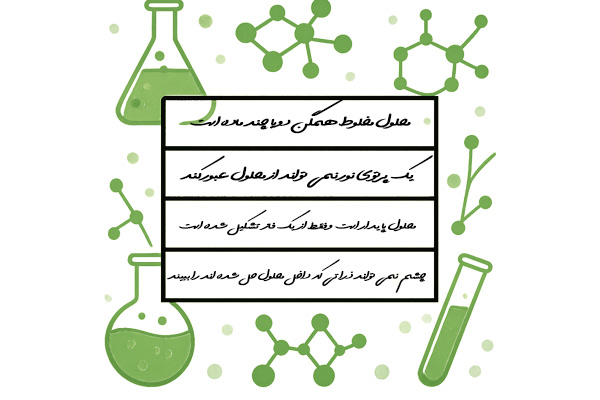
ویژگی محلول ها چیست؟
- محلول مخلوط همگن دو یا چند ماده است.
- یک پرتوی نور نمی تواند از محلول عبور کند.
- محلول پایدار است و فقط از یک فاز تشکیل شده است.
- چشم انسان نمی تواند ذراتی که داخل محلول حل شده اند را ببیند.
- پس از تشکیل محلول، حل شونده را نمی توان با فرآیند تصفیه از محلول جدا کرد.
طبقه بندی محلول ها بر اساس حل شوندگی در آب
محلول ها را می توان بر اساس محلول بودن یا نبودن با آب به دو نوع طبقه بندی کرد.
محلولی که در آن ترکیب همگن به طور کامل در آب حل می شود، یعنی آب به عنوان حلال عمل می کند.
نمونه هایی از این نوع محلول ها عبارتند از شکر، نمک در آب، دی اکسید کربن در آب.
این محلول ها اساسا برخلاف محلول آبی هستند، زیرا حلال موجود در آن ها آب نیست. می تواند هر چیز دیگری مانند بنزین، اتر و غیره باشد. نمونه هایی از این نوع محلول ها شامل فنل فتالئین در بنزن، گوگرد موجود در دی سولفید کربن و غیره هستند.

انواع محلول بر اساس میزان حل شوندگی
محلول ها را می توان بر اساس مقدار حل شونده موجود در محلول به سه نوع طبقه بندی کرد که
در این بخش به شما می گوییم که ویژگی هر کدام از این محلول ها چیست.
1- محلول ها بر اساس مقدار حل شونده اضافه شده محلول اشباع
یک محلول تنها در صورتی اشباع می شود که به حدی برسد تا حل شونده بیشتری در حلال قابل حل نباشد.
2- محلول اشباع نشده
اگر محلول هنوز بتواند حل شونده بیشتری را در حلال حل کند، گفته می شود که اشباع نشده است.
3- محلول فوق اشباع
به محلول هایی که حل شونده در آن ها به مقدار زیاد وجود دارد و دیگر امکان حل کردن حل شونده در آن ها وجود ندارد و با اضافه کردن حل شونده جدید به صورت جامد ته نشین می شوند، محلول های فوق اشباع گفته می شود. این ذرات حل شونده اضافی بعدا به شکل کریستال و با کمک فرآیند تبلور جدا می شوند.
دسته بندی محلول ها بر اساس مقدار حلال
محلول ها را می توان بر اساس مقدار حلال موجود در محلول به دو نوع طبقه بندی کرد.
اگر مقدار حلال در مقایسه با حل شونده کمتر باشد و غلظت محلول زیاد باشد، محلول غلیظ ایجاد شده است.
در محلول رقیق نسبت حلال به حل شونده بیشتر است.
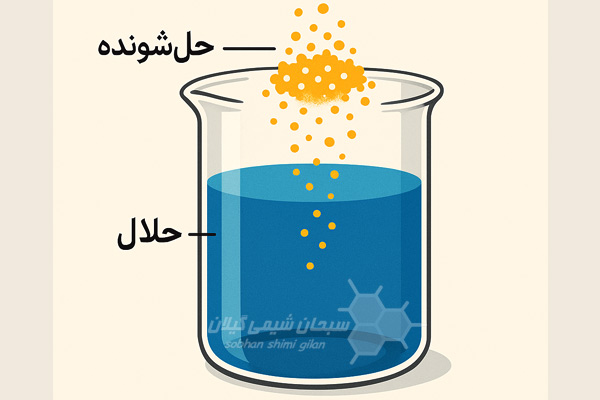
حلال و حل شونده چیست ؟
به مادهای که حلشونده را در خود حل میکند حلال گفته میشود و به دو دسته کلی حلالهای قطبی و ناقطبی تقسیم میشوند. حلالها بیشتر در فاز مایع هستند ولی حلالهایی در فاز گاز، جامد و سیال فوق بحرانی نیز وجود دارد. آب رایجترین حلال مولکولهای قطبی است. یونها و پروتئینهای سلولِ موجودات زنده به صورت محلولهای آبی، درون سلول حل شدهاند. از حلالها در رنگسازی، پاککنندهها، ساخت جوهر و خشکشویی به فراوانی استفاده میکنند.
از ثابت دیالکتریک یا گذردهی نسبی حلالها به عنوان معیاری از قطبی و ناقطبی بودن آنها استفاده میشود. حلالهایی ناقطبی، گذردهی نسبی کمتر از ۱۵ دارند. گذردهی نسبی آب در دمای صفر درجه سلسیوس برابر با ۸۸ است.
حلالهای آلی از جمله ترکیات آلی هستند که در ساختار آنها عنصر کربن وجود دارد. حلالهای آلی برای حل کردن مواد، ساخت محلول و استخراج دیگر مواد کاربرد دارند. این ترکیبات به حلالهای طبیعی و مصنوعی تقسیم میشوند.
1- حلالهای طبیعی: این دسته از حلالهای آلی به طور طبیعی توسط موجودات ساخته میشود.
2- حلالهای مصنوعی: به حلالهایی گفته میشود که توسط انسان با واکنش شیمیایی ترکیبات آلی تولید میشوند.
حلالهای آلی براساس گروههای عاملی موجود در ترکیب خود انواع گوناگونی دارند.
1- حلالهای آلیفاتیک: حلالهای آلیفاتیک مبتنی بر آلکنها ساخته شده و حلالهایی ناقطبی هستند. این حلالها در استخراج نفت، صنعت رنگ و نقاشی، داروسازی، چسبها و بسپار کاربرد دارند.
2- حلالهای آروماتیک: حلالهای آروماتیک نیز حلالهایی ناقطبی هستند و در ساخت چسبها، جوهرها، رنگ، حشرهکشها و فرآیندهای استخراج استفاده میشوند.
3- حلالهای کربونیل: این دسته از حلالهای آلی شامل ترکیبات استری و حلالهایی قطبی هستند. از این حلالها در پاک کنندههای رنگ و لاک، پاککنندههای الکترونیکی، چسبسازی، فرایند کافئینزدایی و همچنین در طعمدهندههای غذا استفاده میکنند.

حلال معدنی غیرآبی از حلالهای غیرآبی هستند که برای محیطهای واکنشِ غیرآبی استفاده میشوند. حلال معدنی غیرآبی به دو دسته زیر تقسیم میشوند.
1- حلالهای پروتیک
در واکنش الکترودها و محیطهای قلیایی کاربرد بیشتری دارند.
2- حلالهای آپروتیک
برای مطالعه ترکیبات الکتروفیلی استفاده میشوند.
برای تشکیل محلول با توجه به ویژگیهای حلشونده، نوع حلال انتخاب میشود. بین یونهای تشکیل دهنده حلشوندههای یونی مانند سدیم کلرید پیوند قوی یونی وجود دارد. در ترکیب پیوند یونی وجود دارند. با وارد شدن بلورهای نمک در آب، اتمهای اکسیژن آب با بار منفی، یونهای سدیم و اتمهای هیدروژن بار جزئی مثبت یونهای کلر را جذب میکنند. یونهای نمک هنگام ورود، آبپوشی یا هیدارته میشوند یعنی مولکولهای آب، یونها را احاطه میکنند. آبپوشی موجب کاهش جاذبه بین یونهای سدیم و کلر و تشکیل محلول میشود. در فرایند حل شدن نمک، آب تنها نقش تفکیککننده را دارد و واکنش دهنده نیست.
متانول یکی از ترکیبات قطبی در ساختار خود، گروه قطبی دارد. با برقراری پیوندهای هیدروژنی بین گروههای این ترکیب و اتمهای آب موجب حل شدن آن در آب میشود. حلشوندههای قطبی مانند متانول در حلالهای قطبی مانند آب حل میشوند.
مولکولهای ناقطبی مانند ید روغن یا گریس در حلالهای قطبی مانند آب حل نمیشوند. بین ذرات حلشوندههای ناقطبی و حلالهای قطبی هیچ جاذبهای وجود ندارد. چنین حلشوندههایی برای تشکیل محلول به حلالهایی ناقطبی نیاز دارند.
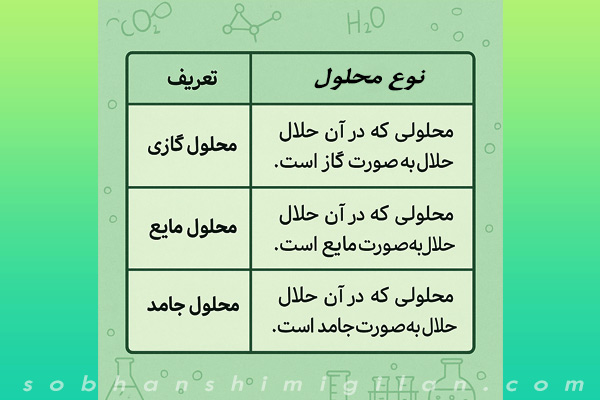
دسته بندی انواع حالات محلول ها
محلول گازی: محلولی که در آن حلال بهصورت گاز است.
محلول مایع: محلولی که در آن حلال بهصورت مایع است.
محلول جامد: محلولی که در آن حلال بهصورت جامد است.
محلول گازی چیست ؟
محلول گازی زمانی تشکیل میشود که حلال و حلشونده در فاز گاز باشند. حرکت براونی و برخوردهای پیدرپی مولکولها موجب همگن ماندن حلالهای گازی میشوند.
گاز در گاز: هوا نمونهای از محلول گازی است که گاز اکسیژن و گازهای دیگر در نیتروژن حل شدهاند.
محلول جامد چیست ؟
وقتی حلال در فاز جامد باشد، محلول جامد تشکیل میشود. گازها، مایعات و جامدها میتوانند در حلالهای جامد حل شده و محلولهای جامد را تشکیل دهند.
گاز در جامد: حل شدن گاز هیدروژن در برخی فلزها مانند پلاتین (Pt)، از محلولهای گاز در جامد هستند. از این ویژگی برای ذخیرهسازی هیدروژن مورد پژوهش قرار گرفته است.
محلول مایع رایجترین شکل محلول است. وقتی حلال در فاز مایع باشد، محلول مایع تشکیل میشود. گازها، مایعات و جامدها میتوانند در حلالهای مایع حل شده و محلولهای مایع را به وجود آورند. در زیر نمونههایی از محلولهای مایع فهرست شده است.
کربن دیاکسید در آب: حل شدن کربن دیاکسید در آب با واکنش شیمیایی و تشکیل یون همراه است. آب گازدار، سودا یا نوشابه مثالهایی از محلول گاز در مایع هستند. حبابهایی که در چنین محلولهایی دیده میشوند، گاز کربن دیاکسید نیستند بلکه تنها «جوششی» (Effervescence) از این گاز در سطح آب را نشان میدهند. گاز کربن دیاکسید در سطح مولکولی حل شده و قابل مشاهده نیست.
مایع در مایع: شامل مخلوطی از دو یا چند ماده در فاز مایع با یکدیگر است.
جامد در مایع: حل شدن مواد جامد در مایع، محلولهای جامد در مایع هستند. حل شدن قند و شکر در آبِ لیمو و تشکیل شربت آبلیمو یا نمک در آب مثالهایی از محلول جامد در مایع هستند.
مایعات بدن یا زیستسیالهاکه بیش از ۵۰ درصد از وزن کل بدن را تشکیل میدهند، محلولهایی با اجزا بسیاری هستند. بسیاری از مایعات بدن به دلیل وجود یونهایی مانند پتاسیم، به شکل الکترولیت هستند. مایعات بدن همچنین حاوی مولکولهای مانند ساکاروز و اوره است. اکسیژن و کربن دیاکسید نیز از اجزا تشکیل دهنده خون هستند و اندازهگیری غلظت آنها برای شناسایی بسیاری از بیماری کاربرد دارد. برخی از مخلوطهای مایع مانند کلوئیدها، سوسپانسیونها، امولسیونها محلول نیستند. این دسته از مواد به دلیل ناهمگن بودن ویژگیهای محلولها را ندارند.
محلول آبی چیست ؟
محلول آبی مخلوطی همگن است که آب در آن نقش حلال را دارد. گونههای حلشونده در محلولهای آبی با نماد aq که کوتاه شده واژه Aqueous است در معادلات شیمیایی نمایش داده میشوند. برای مثال وقتی سدیم کلرید در آب حل میشود به شکل به موادی که به آسانی در آب حل میشوند هیدروفیل یا آبدوست میگویند. در مقابل مواد آبگریز در آب حل نشده و تشکیل محلول آبی نمیدهند. برای مثال روغن از مواد آبگریزی است که در آب حل نمیشود. بسیاری از ترکیبات آلی آبگریز هستند. مولکولهای مواد آبگریز معمولاً مولکولهای ناقطبی هستند و در حلالهای ناقطبی حل میشوند. این مولکولها با در کنار هم قرار گرفتن تشکیل میسل میدهند.
اثر لوتوس یا نیلوفر آبی، به دلیل آبگریزی رخ میدهد. بهطور کلی به دلیل استفاده زیاد از آب و فراوانی این حلال در آزمایشهای شیمی، واژه محلول به محلولهای آبی اشاره دارد. بیشتر در محلولهای غیرآبی، حلال ذکر میشود. در محلولهای آبی واکنشها به صورت متاتسیس انجام میشوند. متاتسیس اصلاحی برای واکنشهای جابجایی دوگانه است. واکنشهای رسوبی از جمله واکنشهای جابجایی دوگانه هستند. برای مثال: وقتی دو محلول الکترولیت قوی با هم مخلوط شوند تشکیل رسوب میدهند.
اصطلاحات اسید، باز و pH تنها برای محلولهای آبی کاربرد دارند. برای مثال، اندازهگیری pH آبلیمو یا سرکه که محلولهایی آبی هستند به راحتی انجام میشود ولی اندازهگیری روغن نباتی نتایج معناداری ارائه نمیدهد. برای تشکیل محلولهای آبی، نیروی جاذبه بین ماده حلشونده و مولکولهای آب باید بیشتر از پیوند هیدروژنی آب باشد.
تفاوت مخلوط و محلول چیست
تفاوت عمده بین مخلوط و محلول در این است که یک مخلوط خواص همه عناصر جایگزین را نشان می دهد. در یک مخلوط ترکیب عناصر ثابت نیست و مخلوط می تواند همگن یا ناهمگن باشد. در حالی که یک محلول مخلوطی از دو یا چند ماده است که به راحتی قابل جداسازی نیستند. تعداد موادی که در ساخت یک مخلوط شرکت می کنند، می تواند متفاوت باشد و مقدار ثابتی ندارد. در حالی که در محلول ها میزان حل شدن املاح در حلال، میزان معینی دارد.
مخلوط ترکیبی از دو یا چند ماده است که در آن هر ماده فقط با هم مخلوط شده است و هیچ ترکیب جدیدی تشکیل نشده و خصوصیات و خواص فردی هر ماده ثابت باقی می ماند. به عنوان مثال، کریستال های شکر مخلوط شده با دانه های نمک یا ماسه حل شده در آب نمونه های از یک مخلوط هستند. شما به راحتی می توانید اجزا این مخلوط ها را از یکدیگر جدا کنید. از طرف دیگر در محلول ها مواد مختلف نه تنها با هم مخلوط می شوند بلکه کاملا در یکدیگر نیز حل می شوند. برای مثال می توان به حل شدن بلورهای شکر در آب اشاره کرد.